目 录 上一节 下一节 查 找 检 索 手机阅读 总目录 问题反馈
附录C 医药洁净室的验证
C.0.1 医药洁净室的验证应包括下列内容:
1 医药洁净室的验证,应包括室内系统及设施,如净化空气、工艺用水等系统及设施的设计确认、安装确认、运行确认和性能确认;
2 系统设计确认,应包括对满足用户需求的各项设计原理、实施计划做深化的设计审核;
3 系统及设施的安装确认,应包括各分部工程的外观检查和单机试运转;
4 系统及设施的运行确认,应在安装确认合格后进行。内容应包括带冷(热)源的系统联合试运转,并不应少于8h;
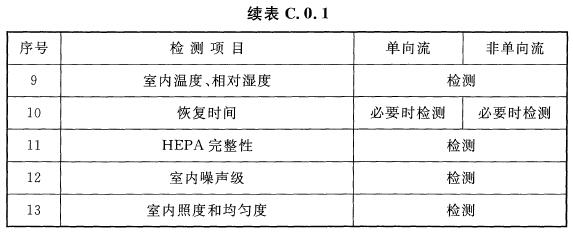
5 医药洁净室的综合性能确认,应包括表C.0.1项目的检测和评价。

C.0.2 医药洁净室的验证,应符合下列现行国家标准的有关规定:
1 《洁净室施工及验收规范》GB 50591;
2 《医药工业洁净室(区)悬浮粒子的测试方法》GB/T 16292;
3 《医药工业洁净室(区)浮悬菌的测试方法》GB/T 16293;
4 《医药工业洁净室(区)沉降菌的测试方法》GB/T 16294;
5 《表面微生物测试方法》;
6 《药品生产质量管理规范》(2010年修订);
7 《中华人民共和国药典》(2015版)。
C.0.3 医药洁净室的验证应包括下列文件:
1 医药洁净室主要设计文件和竣工图;
2 主要设备的出厂合格证书、检验文件;
3 设备开箱检查记录、管道压力试验记录、管道系统吹洗脱脂记录、风管漏风记录、竣工验收记录;
4 单机试运转、系统联合试运转和医药洁净室性能测试记录。
顶部
- 上一节:附录B 医药洁净室的维护管理
- 下一节:本标准用词说明
目录导航
- 前言
- 1 总则
- 2 术语
- 3 生产区域的环境参数
- 3.1 一般规定
- 3.2 环境参数的设计要求
- 4 厂址选择和总平面布置
- 4.1 厂址选择
- 4.2 总平面布置
- 5 工艺设计
- 5.1 工艺布局
- 5.2 人员净化
- 5.3 物料净化
- 5.4 工艺用水
- 6 工艺管道
- 6.1 一般规定
- 6.2 管道材料、阀门和附件
- 6.3 管道的安装、保温
- 6.4 安全技术
- 7 工艺设备
- 7.1 一般规定
- 7.2 设计和选用
- 8 建筑设计
- 8.1 一般规定
- 8.2 防火和疏散
- 8.3 室内装修
- 9 空气净化
- 9.1 一般规定
- 9.2 净化空气调节系统
- 9.3 气流流型和送风量
- 9.4 风管和附件
- 9.5 监测与控制
- 9.6 生产特殊性质药品医药洁净室的要求
- 10 给水排水
- 10.1 一般规定
- 10.2 给水
- 10.3 排水
- 10.4 消防设施
- 11 电气设计
- 11.1 配电
- 11.2 照明
- 11.3 通信
- 11.4 静电防护及接地
- 附录A 药品生产环境的空气洁净度级别举例
- 附录B 医药洁净室的维护管理
- 附录C 医药洁净室的验证
- 本标准用词说明
- 引用标准名录
-
笔记需登录后才能查看哦~


 京公网安备110105014475
京公网安备110105014475